Моноцитоз
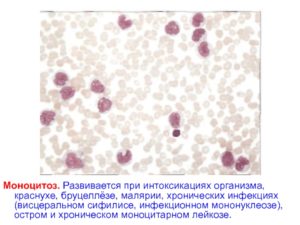
Моноцитоз – это патологическое состояние, при котором наблюдается увеличение содержания моноцитов больше 1000 в 1 мкл крови. Причинами служат инфекционные, воспалительные, а также онкогематологические заболевания. У детей наиболее частой причиной выступает инфекционный мононуклеоз.
Специфических симптомов нет. Клиническая картина определяется основной патологией. Уровень моноцитов исследуется в капиллярной или венозной крови при подсчете лейкоцитарной формулы.
Для возврата моноцитов к референсным показателям (от 1 до 10%) проводится лечение болезни, послужившей фоном для возникновения моноцитоза.
Четких цифровых разделений моноцитоза нет. Условно различают умеренный и выраженный моноцитоз. По патогенетическому механизму выделяют:
- Реактивный моноцитоз. Причиной данной разновидности являются воспалительные и инфекционные патологии.
- Неопластический (злокачественный) моноцитоз. Встречается у больных миелопролиферативными и лимфопролиферативными заболеваниями (у детей при лимфогранулематозе и остром монобластном лейкозе).
У детей с момента рождения наблюдается небольшое повышение моноцитов, оно достигает максимума к концу 1 недели жизни (до 15%), далее медленно снижается и к 12 месяцу становится как у взрослых.
Реконвалесценция
Несмотря на большое многообразие патологических причин, чаще всего моноцитоз свидетельствует о выздоровлении после острого инфекционного заболевания. Как правило, в основном это наблюдается у детей.
Повышение уровня моноцитов после инфекции означает, что произошла полная элиминация инфекционного агента.
Моноцитоз обычно незначительный, может сохраняться до 2-х недель, затем уровень моноцитов возвращается к нормальным показателям.
Вирусные инфекции
Моноциты являются первой линией противоинфекционной защиты. Мигрируя в ткани, они превращаются в мононуклеарные фагоциты (макрофаги).
При проникновении микроорганизма (бактерии, вируса) макрофаги его поглощают (фагоцитируют), а также презентируют на своей поверхности чужеродные антигены патогена для распознавания их Т- и B-лимфоцитами.
Кроме того, макрофаги выделяют широкий спектр различных медиаторов и цитокинов, вызывая хемотаксис нейтрофилов к очагу инфекционного воспаления. Нередко вирусные инфекции, кроме моноцитоза, становятся еще и причиной увеличения лимфоцитов (лимфомоноцитоз).
- Острые вирусные инфекции. Из всех заболеваний, самой распространенной причиной моноцитоза среди взрослых являются грипп, ОРВИ (парагрипп, аденовирусная, риновирусная инфекции). Обычно моноцитоз незначительный, он возникает резко наряду с симптоматикой, затем уменьшается до нормы примерно через 1-2 недели после стихания воспалительного процесса.
- Инфекционный мононуклеоз. Еще одной вирусной причиной моноцитоза, особенно часто встречающейся у детей, признан инфекционный мононуклеоз, вызванный вирусом Эпштейн-Барра. Ввиду длительного персистирования вируса в организме, моноцитоз может сохраняться несколько месяцев и даже лет. Также в острый период мононуклеоза в крови появляется большое количество лимфоцитов, приобретающих моноцитарные морфологические свойства (атипичных мононуклеаров) – увеличивается размер клетки и клеточного ядра, цитоплазма становится базофильной.
Моноцитоз характерен для хронических бактериальных инфекций, сопровождающихся эпителиоидноклеточной пролиферацией с образованием гранулем. В первую очередь к ним относятся туберкулез, бруцеллез, сифилис.
Также моноцитоз встречается при подостром бактериальном эндокардите, риккетсиозах. Патогенез повышения содержания моноцитов в крови при этих заболеваниях несколько отличается от такового от вирусных инфекций.
Причиной считается неэффективный фагоцитоз. Макрофаги, поглотив бактерии, не способны уничтожить их внутри себя, так как многие из этих бактерий устойчивы к разрушительному действию лизосомальных ферментов макрофагов.
Вследствие этого они выступают убежищем для бактерий, защищая их от других иммунных клеток, и, позволяя им размножаться, участвуют в формировании гранулемы.
Выделяя цитокины, макрофаги стимулируют образование новых моноцитов в костном мозге, обеспечивая бактерии новыми «убежищами».
Таким образом поддерживается хроническое течение болезни. Повышение концентрации моноцитов умеренное, из-за хронического течения патологии может сохраняться месяцами, годами, опускается до нормальных цифр только после этиотропного лечения. Единственной острой бактериальной инфекцией, вызывающей моноцитоз у детей, признана скарлатина.
Моноцитоз часто возникает на фоне инфекционных заболеваний
Системные гранулематозные процессы
Хронические неинфекционные системные воспалительные заболевания также сопровождаются моноцитозом, механизм развития которого заключается в следующем. По неизвестным причинам запускается клеточно-опосредованная иммунная реакция.
Макрофаги (тканевые моноциты), наряду с лимфоцитами и тучными клетками начинают скапливаться в различных органах, постепенно образуя гигантоклеточные гранулемы.
Секретируя интерлейкины, цитокины и другие медиаторы, макрофаги поддерживают хроническое воспаление.
У взрослых причиной становятся саркоидоз, гистиоцитоз из клеток Лангерганса, гранулематоз Вегенера. Из системных гранулематозных патологий у детей чаще встречаются воспалительные заболевания кишечника (неспецифический язвенный колит, болезнь Крона). Моноцитоз умеренной степени, но несколько выше, чем при бактериальных и вирусных инфекциях, снижается под влиянием патогенетического лечения.
Причины моноцитоза при коллагенозах точно неизвестны. Существует теория, что под влиянием аутоантител к различным компонентам соединительной ткани и цитокинов стимулируется костномозговое созревание моноцитов.
Также изучена роль моноцитов в индукции и поддержании хронического воспаления. Причиной моноцитоза у взрослых выступают системная красная волчанка, системная склеродермия, у детей в основном наблюдается дермато- и полимиозит.
Степень моноцитоза коррелирует с активностью заболевания, во время ремиссии находится в пределах референсных значений.
Злокачественные болезни крови
Довольно частой причиной моноцитоза являются онкогематологические заболевания. Механизм увеличения количества моноцитов заключается в опухолевой трансформации стволовых клеток костного мозга.
Моноцитоз очень высокий, клетки могут составлять более 50% от общего числа лейкоцитов.
Моноцитоз сохраняется длительное время, снижается только после лечения химиотерапевтическими препаратами или трансплантации костного мозга.
Для взрослых более характерен хронический миелолейкоз. У детей причинами моноцитоза чаще выступают лимфогранулематоз (лимфома Ходжкина), острый монобластный (моноцитарный) лейкоз.
Помимо количественных изменений, при острых лейкозах встречается такой феномен как лейкемический провал, подразумевающий наличие только зрелых форм лейкоцитов и большого количества бластных клеток, отсутствие промежуточных форм.
Нейтропении
Еще одной причиной моноцитоза, часто наблюдаемой у детей, признаны заболевания, сопровождающиеся снижением (главным образом генетически детерминированным) выработки костным мозгом нейтрофильных гранулоцитов — нейтрофилов.
К ним относят циклическую нейтропению, синдром Костмана (детский агранулоцитоз), хроническую нейтропению с нарушением выхода гранулоцитов из костного мозга (миелокахексию). Точный механизм моноцитоза при этих патологиях неизвестен.
Обычно наблюдается умеренный моноцитоз в сочетании с эозинофилией.
Редкие причины
- Паразитарные инфекции: висцеральный, кожный лейшманиоз, малярия.
- Отравления: фосфором, тетрахлорэтаном.
- Прием ЛС: длительное введение глюкокортикостероидов.
- Восстановление костномозгового кроветворения: после миелосупрессии химиотерапевтическими препаратами.
Диагностика
Уровень моноцитов измеряется во время подсчета лейкоцитарной формулы в клиническом анализе крови. Обнаружение моноцитоза требует консультации медицинского специалиста, желательно терапевта.
Врач должен провести опрос жалоб больного, собрать анамнестические данные, выполнить общий осмотр на предмет выявления признаков того или иного заболевания.
Полученные данные служат подспорьем для назначения дополнительного обследования для выяснения причины моноцитоза:
- Анализы крови. В общем анализе крови проводится подсчет общего количества, процентного соотношения всех форм лейкоцитов (лейкоцитарная формула), определяется СОЭ. В мазке крови проверяется наличие атипичных мононуклеаров. Исследуется уровень аутоантител (к ДНК, мышечным клеткам, к топоизомеразе), антигранулоцитарных антител, СРБ. Проводится иммуногистохимический анализ и иммунофенотипирование клеток для выявления поверхностных специфических или опухолевых CD-маркеров.
- Микробиологические исследования. Для идентификации инфекционного возбудителя выполняется бактериологический посев и микроскопия мокроты. Методом иммуноферментного анализа и полимеразной цепной реакции определяются антитела к вирусам, бактериям, их ДНК. Проводятся серологические анализы (реакции непрямой гемагглютинации, микропреципитации).
- Рентгенография. При туберкулезе, саркоидозе на рентгенографии легких обнаруживается увеличение медиастинальных, прикорневых лимфатических узлов, при гистиоцитозе – двусторонние мелкоочаговые затемнения. Также для гистиоцитоза характерны участки остеолизиса и деструкции на рентгенограммах плоских костей черепа, длинных трубчатых костей.
- Сонография. Во время проведения УЗИ брюшной полости у пациентов с инфекционным мононуклеозом, бруцеллезом, онкогематологическими заболеваниями отмечается спленомегалия, реже гепатомегалия. На эхокардиографии у больных коллагенозами иногда удается выявить утолщение листков перикарда, выпот в перикардиальную сумку.
- Гистологические исследования. При злокачественных болезнях крови в мазке костного мозга, полученном путем стернальной пункции либо трепанобиопсии, обнаруживается большое количество бластных клеток. При микроскопическом исследовании бронхоальвеолярной жидкости у пациентов с гистиоцитозом отмечаются гигантские клетки Лангерганса, имеющие эозинофильную цитоплазму. В биоптате лимфоузла при лимфомах выявляются пролиферация лимфоидных клеток, клетки Березовского-Штернберга.
Лабораторная диагностика моноцитоза
Консервативная терапия
Привести уровень моноцитов к нормальным значениям напрямую невозможно. Для этого необходимо бороться с причиной, т.е. лечить основную патологию, на фоне которой развился моноцитоз.
Если моноцитоз обнаружен в крови у человека, недавно перенесшего острое инфекционное заболевание, то лечение не требуется. Это абсолютно нормальное явление, концентрация моноцитов самостоятельно нормализуется через несколько дней.
В случае продолжительного и, тем более, высокого моноцитоза, необходимо медицинское вмешательство:
- Противоинфекционное лечение. Для лечения большинства вирусных инфекций достаточно лишь постельного режима, обильного горячего питья, использования нестероидных противовоспалительных препаратов (парацетамол, ибупрофен), а также симптоматической терапии (полоскание или орошение горла антисептическими, обезболивающими растворами, спреями, закапывание в нос сосудосуживающих капель). При бактериальных инфекциях назначаются антибиотики, при туберкулезе – комбинация противотуберкулезных средств.
- Противовоспалительное лечение. В качестве патогенетического лечения хронических гранулематозных заболеваний, коллагенозов используются лекарственные препараты, подавляющие воспаление – глюкокортикостероиды (преднизолон, метилпреднизолон). Для более мощного противовоспалительного действия эффективны иммуносупрессанты – метотрексат, циклофосфамид.
- Химиотерапия. Для лечения злокачественных болезней крови, гистиоцитоза необходимо проведение курсов химиотерапевтического лечения. Иногда приходится прибегать к интратекальному введению препаратов (введению в цереброспинальную жидкость).
Хирургическое лечение
Существует хирургический способ лечения онкогематологических заболеваний и некоторых видов врожденных нейтропений, позволяющий добиться полного исцеления от болезни, – это пересадка донорских гемопоэтических стволовых клеток.
Для проведения этой операции необходимо выполнить HLA-типирования (генетический тест, определяющий антигены гистосовместимости) с целью подбора подходящего донора.
Однако к данному методу лечения прибегают в крайнем случае при безуспешности консервативной терапии, так как он ассоциирован с высоким риском летального исхода.
Прогноз
Сам моноцитоз не является индикатором прогноза. Исход напрямую определяется причиной моноцитоза. Например, физиологический моноцитоз у детей никак не влияет на продолжительность жизни.
Некоторые хронические гранулематозные заболевания, в частности, саркоидоз, иногда даже без всякого лечения заканчиваются самостоятельной ремиссией.
Онкогематологические патологии и наследственные нейтропении у детей, напротив, характеризуются неблагоприятным прогнозом и большой вероятностью смерти.
Источник: https://www.KrasotaiMedicina.ru/symptom/blood/monocytosis
Лейкопения после химиотерапии
Токсическое влияние на костный мозг. Лейкопения после химиотерапии – это снижение количества клеток крови, обеспечивающих защиту человека от инфекций и являющихся значимой частью клеточного иммунитета.
В костном мозге в постоянном режиме создаются и формируются все основные клетки крови. Кроветворение — это очень активная область организма. Цитостатики всегда негативно влияют на костномозговые функции, подавляя выработку следующих клеток:
· Эритроцитов;
· Тромбоцитов;
· Нейтрофильных лейкоцитов.
Падение уровня эритроцитов становится причиной постоянной усталости на фоне анемии, тромбоцитопения повышает риск кровотечений. С лейкоцитами все значительно хуже, потому что белые кровяные клетки являются основой противоинфекционного и клеточного иммунитета.
Лейкопения после химиотерапии – это отсутствие эффективной защиты от микробов с обязательным подавлением иммунного ответа на любые внешние воздействия.
Факторы риска
У части пациенток лейкопения после химиотерапии бывает более выражена, а восстановление кроветворения после окончания лечения проходит значительно медленнее (в худшем случае количество некоторых видов лейкоцитов восстанавливаются только через 6-9 месяцев после завершения ХТ). К факторам риска относятся:
· Возраст (чем старше, тем костный мозг хуже реагирует на ХТ, а у молодых процессы восстановления проходят динамичнее);
· Схемы и дозы химиотерапии (часть препаратов более токсичны в отношении костномозгового кроветворения);
· Исходное состояние печени (при наличии хронических болезней и неспособности печени обеспечивать защиту организма от препаратов, токсичность лекарственных средств возрастает);
· Сочетание ХТ и лучевой терапии (вместе лекарства и облучение сильнее давят костный мозг);
· Исходно имеющееся истощение пациентки, возникающее при запущенной онкологии.
В той или иной степени лейкопения после химиотерапии будет, поэтому необходимо следить за состоянием крови и создавать условия для быстрого восстановления иммунной защиты.
Варианты снижения уровня лейкоцитов
Норма у здорового человека – от 4000 до 9000х109 в 1 литре крови. Всё, что ниже 4 тысяч, относится к лейкопении. Чаще всего падение уровня белых клеток крови происходит через 1-2 недели от начала ХТ.
Восстановление концентрации нейтрофильных лейкоцитов занимает, в лучшем случае, не менее 2-х недель. Возможны варианты — и падает количество через месяц, и возвращается к норме через 7-8 недель.
При выявлении в общем анализе крови уровня в 1500 и ниже очередной курс химиотерапии будет отложен, потому что возникает реальный риск для появления тяжелого осложнения – фебрильной нейтропении.
Лейкопения после химиотерапии: какова опасность
Самое неприятное и опасное – попадание инфекции в ослабленный противоопухолевым лечением организм.
Падение уровня лейкоцитов после химиотерапии может стать основной причиной осложненного протекания инфекционно-воспалительного процесса: у пациенток на фоне и после курса ХТ риск заражения микробами и тяжелого протекания болезни значительно выше, чем у здоровых людей.
Даже банальный ОРЗ может быстро перейти в тяжелую форму пневмонии. Или кариес в зубе может стать причиной сепсиса (заражения крови). Особенно опасно для жизни, если возникает фебрильная нейтропения. Каждой пациентке необходимо обращаться к врачу при возникновении следующих симптомов:
· Скачок температуры более 38°C;
· Любые проявления ОРЗ (насморк, кашель, першение в горле);
· Учащенное болезненное мочеиспускание;
· Ознобы и ночная потливость.
Важно понимать – на фоне ХТ нет собственной эффективной противомикробной защиты, поэтому даже простой насморк может стать основой для серьезных инфекционно-воспалительных осложнений.
Профилактика и лечение
Задавленный клеточный иммунитет. задача – предупредить заражение микробами. К эффективным мерам профилактики относятся:
· Избегать любое скопление людей (не надо ходить в кинотеатр, на концерты, в театр), где можно легко получить вирусную инфекцию;
· Часто мыть руки (не только перед едой и после посещения туалета);
· Тщательно соблюдать гигиену, но не пользоваться грубыми мочалками, жесткими щетками для чистки зубов;
· Следить за ногтями, предвосхищая появление заусениц;
· Увлажнять кожу, особенно при нарастании сухости;
· Категорически недопустимо выдавливать угри;
· Отказаться от депиляции;
· Своевременно обрабатывать порезы и мелкие травмы антисептиками.
При умеренном снижении лейкоцитов после химиотерапии в домашних условиях можно использовать рекомендованные врачом биопрепараты (Лейкоген, Метилурацил). В рацион питания надо вводить следующие продукты:
· Куриное яйцо;
· Рыбная икра;
· Орехи;
· Свежие овощи;
· Фрукты;
· Сок папайи или манго;
· Пшеничные отруби;
· Овсяная каша;
· Чечевица.
При выраженном снижении лейкоцитов доктор назначит гормональную терапию преднизолоном. Хороший вариант – за несколько дней и во время ХТ использовать препарат-стимулятор выработки нейтрофилов. При значительном ухудшении показателей крови (падение уровня ниже 1000) лечение проводится в больнице с использованием специальных лекарств-колониестимулирующих факторов.
Лейкопения после химиотерапии – это чаще всего проблема ближайших недель после завершения курсового лекарственного лечения. Но в некоторых случаях уровень лейкоцитов восстанавливается только через несколько месяцев. И все это время надо соблюдать профилактические мероприятия по предупреждению заражения бактериями и вирусами.
на сайте parashistay.ru
Источник: https://zen.yandex.ru/media/id/5b6d6f868f29f600a9848967/5d39e012fbe6e700ad3f83ae
Лейкопения: причины возникновения, лечение и виды заболевания
Лимфогранулематоз, нейтропения, лейкопения, моноцитоз — все эти довольно распространенные заболевания связывает только одно — патологические изменения на уровне белых кровяных телец. В данной статье мы подробно рассмотрим только один вариант из этого списка.
Лейкопения — это патологическое состояние, которое характеризуется нарушением на уровне кроветворения белых кровяных телец. К сожалению, в последнее время распространенность данного недуга растет. Чем это объясняется?
Что такое лейкопения у взрослых?
Это особое патологическое состояние, которое подразумевает под собой пониженное содержание в крови белых кровяных телец, когда их количество падает ниже отметки в 3,7Х109/л. Такая ситуация говорит об уменьшении выработки лейкоцитов непосредственно в самом костном мозге. Это может являться следствием различного рода нарушений и заболеваний.
Пониженное содержание лейкоцитов в крови очень часто наблюдается без какого-либо ухудшения состояния пациента. С другой стороны, изменение иммунитета при данном заболевании нередко влечет за собой возникновение различных инфекционных недугов.
Быстрая утомляемость, озноб с одновременным повышением температуры, головокружение — все эти симптомы позволяют заподозрить такой диагноз, как лейкопения. Причины возникновения таких клинических признаков в течение длительного времени могут оставаться неизвестными.
Окончательно диагноз может подтвердить только анализ крови.
Белые кровяные тельца непрерывно образуются в костном мозге, лимфоузлах и селезенке. Они постоянно циркулируют в кровеносной системе. Общее их количество можно подсчитать с помощью специального анализа.
В норме их число варьируется от 4,0 до 8,0Х109 на литр крови. Повышенное содержание именуется лейкоцитозом. Чаще всего таким образом организм реагирует на имеющийся воспалительный процесс. Все дело в том, что именно лейкоциты убивают все чужеродные клетки.
Снижение количества белых кровяных телец называется лейкопенией.
В зависимости от наличия внутри самих клеток зернистости врачи называют два типа лейкоцитов:
- Гранулоциты: эозинофилы (до 5%), базофилы (до 1%), нейтрофилы (40-70%).
- Агранулоциты: лимфоциты (20-45%), моноциты (3-8%).
Простой пересчет указывает на то, что на гранулоциты приходится более половины всего состава, причем 90% из них — это нейтрофилы.
Иначе они называются фагоцитами. Специалисты их прозвали так потому, что они отличаются способностью уничтожать микроорганизмы.
Таким образом, следует различать повышенное содержание белых кровяных телец и пониженное. Именно последнее и носит название лейкопения.
Лечение данного заболевания невозможно до тех пор, пока врач не будет точно знать главную причину, которая и вызвала лейкопению. В противном случае будет назначена неправильная терапия, а болезнь продолжит прогрессировать.
Факторов, провоцирующих развитие данного недуга, специалисты называют великое множество. Однако чаще всего это нарушение функционирования костного мозга, при котором наблюдается угнетение синтеза нейтрофилов вследствие:
- неоднократного воздействия ионизирующего излучения (частые и длительные рентгенологические исследования, лучевая болезнь);
- инфекционных болезней (ВИЧ, септические заболевания, герпетическая инфекция);
- длительного приема некоторых групп лекарственных препаратов (антибиотики, нестероидные противовоспалительные средства, сульфаниламиды);
- отравления токсинами и бытовыми ядами;
- дефицита витаминов группы В и некоторых микроэлементов;
- диспластических и опухолевых поражений непосредственно самого костного мозга, которые также являются причиной заболевания лейкопения (лейкоз, метастатические поражения и т. д.).
По словам специалистов, стремительное разрушение так называемых гранулоцитов наблюдается вследствие:
- Аутоиммунных деструктивных процессов в организме.
- Применения химиотерапии.
- Задержки лейкоцитов в аппарате на фоне осуществления гемодиализа.
Клинические проявления
На начальной стадии развития болезни явные признаки лейкопении практически всегда отсутствуют. У пациента могут появиться головные боли, слабость, головокружение. Как правило, на эти сигналы никто не обращает внимания, однако клиническая картина в это время продолжает стремительно меняться. На фоне ослабленного организма зачастую происходит его инфицирование, что сопровождается:
- мигренями;
- лихорадкой;
- ознобом;
- учащенным пульсом.
Достаточно часто появляются поражения слизистой ЖКТ в виде многочисленных язв и эрозий, инфекции крови, воспалительные процессы в ротовой полости.
Следует уделить внимание и особенностям течения недуга. Все инфекционные процессы в организме протекают в несколько раз тяжелее. К примеру, небольшое раздражение на кожных покровах может привести к флегмоне.
Очень часто после химиотерапии наблюдается поражение селезенки, печени и клеток кишечника. Любая инфекция в данном случае становится опасной для жизни пациента. Благодаря анализу крови, как правило, обнаруживается не только лейкопения.
Тромбоцитопения, к примеру, практически всегда неизбежно развивается на фоне угнетения продуцирования тромбоцитов.
Чем опасно данное заболевание?
Стойкая лейкопения, по словам врачей, приводит к снижению иммунитета и одновременному повышению чувствительности ко многим инфекциям и онкологическим недугам, что нередко влечет за собой летальный исход. Крайними проявлениями заболевания считаются следующие: агранулоцитоз, нейтропения и алейкия. В этом случае организм практически полностью перестает продуцировать те или иные типы лейкоцитов.
Классификация
Достаточно часто снижение уровня белых кровяных телец носит временный характер. Как известно, причины лейкопении у взрослых нередко кроются в приеме некоторых лекарственных препаратов (средства «Бисептол», «Анальгин»).
После окончания действия поражающего фактора все симптомы проходят. Здесь речь прежде всего идет о так называемой транзиторной лейкопении.
Она обнаруживается во время очередного исследования крови и не имеет каких-либо серьезных последствий для здоровья.
Более длительную реакцию специалисты подразделяют на следующие виды:
- острая (до трех месяцев);
- хроническая (более трех месяцев).
Подобные состояния нередко вызывают подозрение на агранулоцитоз и всегда требуют более детального обследования.
Также заболевание лейкопения подразделяется на:
- первичную форму (возникает вследствие нарушения синтеза нейтрофилов);
- вторичную форму (появляются факторы, угнетающие привычное кроветворение).
Исходя из степени снижения числа лейкоцитов, в диагнозе может быть указано три варианта:
- легкая степень — 1,5Х109/л (полное отсутствие осложнений);
- средняя — от 0,5 до 1,0Х109/л (существует риск инфекционных осложнений);
- тяжелая — до 0,5Х109/л (агранулоцитоз с тяжелыми проявлениями).
Именно по последней классификации чаще всего и разделяется лейкопения. Степени развития данного патологического состояния зависят исключительно от вероятности присоединения инфекции.
Диагностика
Чтобы подтвердить данное заболевание, врач назначает пациенту общий анализ крови. По его результатам можно судить о наличии недуга. Затем, как правило, назначается консультация у терапевта и даже гематолога.
На ней врач рассказывает, что представляет собой заболевание лейкопения, причины возникновения данного патологического состояния.
Важно заметить, что, если специалист не будет знать, какие именно факторы спровоцировали развитие болезни, могут возникнуть трудности с назначением терапии и ее последующей эффективностью.
В первую очередь пациента помещают в отдельную палату. Врачи и другие медработники в обязательном порядке обрабатывают руки антисептиком, пользуются марлевыми повязками и переодеваются в стерильные халаты. В самой палате уборка осуществляется с использованием дезинфицирующих средств, применяются бактерицидные лампы.
Как лечить лейкопению? В случае умеренного варианта заболевания назначаются следующие препараты: «Лейкоген», «Батилол», «Пентоксил». При возникновении бактериальных осложнений, когда на кожных покровах появляются повреждения, с первых дней рекомендуются антибиотики широкого спектра (средства «Цепорин», «Ампициллин», «Гентамицин»).
Лейкопения после курса химиотерапии лечится лекарствами, полученными посредством генной инженерии (препараты «Ленограстим», «Сарграмостин», «Филграстим»).
Важно заметить, что потребуется достаточно много времени, чтобы окончательно побороть такой недуг, как лейкопения. Причины возникновения заболевания, как уже было отмечено выше, зачастую кроются в дефиците некоторых витаминов и микроэлементов. Именно поэтому в процессе лечения необходимо уделять особое внимание соответствующей диете.
Благотворно влияют на созревание новых клеток и синтез гемоглобина продукты, богатые фолиевой и аскорбиновой кислотой. Ежедневный рацион в обязательном порядке должен состоять из разнообразных фруктов и овощей, свежей зелени и ягод. Рекомендуется кушать каши из рисовой, гречневой и других круп.
Как видно, диета не отличается особой строгостью, однако от некоторых продуктов все же придется отказаться. В эту группу входит жирное мясо, сладкая газировка, фастфуд.
В случае инфекционного заражения назначается терапия, состоящая преимущественно из препаратов, не воздействующих на сам костный мозг.
В обязательном порядке применяются витамины, иммуномодуляторы, переливание тромбоцитарной и лейкоцитарной массы. В особо тяжелых случаях врачи прибегают к удалению селезенки.
Оперативное вмешательство назначается в том случае, если была доказана ее роль в разрушении лейкоцитов.
Возможные последствия
Современная медицина выделяет различные виды лейкопении, классификация которых в первую очередь зависит от факторов, способствующих резкому снижению числа белых кровяных телец.
Однако, вне зависимости от вида заболевания, следует незамедлительно принять все необходимые меры для борьбы с ним.
Если своевременно не будет назначено лечение, велика вероятность развития осложнений, причем опасных для жизни пациента.
Многие, увидев анализ крови, не знают, чем в действительности грозит лейкопения. Большинство полагает, что негативные последствия могут вызвать исключительно те заболевания, которые и спровоцировали резкое снижение белых кровяных телец. На самом деле, такое мнение неправильно. Лейкопения ослабляет защитные функции организма.
Отсутствие отличного иммунитета нередко приводит к тому, что присутствие самой банальной бактериальной инфекции в организме может стать чрезвычайной ситуацией. Более того, при лейкопении практически в два раза увеличивается риск приобрести опухолевое заболевание.
Также к возможным последствиям данного патологического состояния можно отнести агранулоцитоз и алейкию (поражение костного мозга).
Профилактика и прогноз
Очень часто после онкологических заболеваний развивается лейкопения. После химиотерапии лечение и профилактика данного недуга в первую очередь подразумевают под собой точный подбор дозировки препаратов.
Важно заметить, что это зависит не только от опыта врачей, но также и от возможностей специализированных аппаратов. Именно поэтому для лучевой терапии применяется максимально целевое воздействие.
Смертность в случае лейкопении у онкологических больных не превышает 30% от всех случаев.
Особое внимание важно уделять индивидуальному подходу в лечении пациентов в поликлиниках.
При назначении тех или иных препаратов врач в обязательном порядке должен учитывать наличие непереносимости некоторых компонентов, совместимость препаратов, сопутствующие недуги.
Здесь особая роль принадлежит самостоятельному лечению и следованию советам близких и родных. Всякая терапия должна назначаться только после диагностического обследования, а также консультации у специалиста.
В данной статье мы максимально подробно рассказали о том, что представляет собой лейкопения. Причины возникновения данного заболевания могут быть самыми различными, начиная с нехватки некоторых витаминов и заканчивая серьезными поражениями костного мозга. В любом случае, только грамотная терапия способна помочь в борьбе с этим недугом.
Источник: https://FB.ru/article/165500/leykopeniya-prichinyi-vozniknoveniya-lechenie-i-vidyi-zabolevaniya
Анализ крови на описторхоз и расшифровка результатов
Описторхозом называют паразитарную болезнь, которая в первую очередь сопровождается поражением печени и желчевыводящих путей. Возбудителем является плоский паразит из класса сосальщики.
Инфицирование происходит при употреблении рыбы, зараженной личинками. При подозрении на патологию сдают кровь на описторхоз. Лабораторное исследование проводится несколькими методиками, позволяющими точно узнать, болен человек или нет.
Рассмотрим, когда нужно это исследование, как проводится, и о чем говорят результаты.
Когда нужен анализ крови на описторхоз?
Клиника болезни обусловлена особенностями жизненного цикла гельминта, количеством личинок, проникших в организм. Также частотой вторичных заражений, исходным состоянием иммунного статуса человека.
Многие люди воспринимают симптоматику паразитарного заболевания как следствие чрезмерной физической активности, простудных болезней, общего недомогания, расстройства пищеварения. Нередко бывает, что на приеме у медицинского специалиста выявляется, что человек проживает/проживал в очаге описторхоза либо потреблял сырую или плохо термически обработанную рыбу.
Анализ крови на описторхоз необходим в тех случаях, когда пациент жалуется на следующие симптомы:
- Постоянная вялость и слабость;
- Беспричинное увеличение температуры тела;
- Повышенное потоотделение;
- Частые респираторные и простудные заболевания;
- Кожные проблемы – жжение, зуд, высыпания и пр.;
- Болят суставы и мышцы;
- Головные боли;
- Непродуктивный кашель;
- Пожелтение кожного покрова;
- Болезненные ощущения в животе;
- Нарушение пищеварения и т.д.
При выявлении такой симптоматики рекомендуется пройти исследование. Своевременная диагностика позволяет предупредить многочисленные осложнения паразитарного заболевания. В частности, флегмону желчного пузыря, хронический гепатит, язвенные патологии желудка, острый панкреатит, рак печени и желчных протоков.
К сведению, врачи рекомендуют делать анализ раз в три месяца людям, чья деятельность связана с рыбной и сельскохозяйственной промышленностью.
Перечисленные клинические проявления выше обычно свидетельствуют об острой фазе заболевания. При хроническом течение симптомы несколько «смазаны», часто наблюдаются обострения, сменяющиеся периодами ремиссии.
Способы диагностики описторхоза
Общий анализ крови и биохимия обязательно осуществляют при подозрении на описторхоз. По крови больного можно подтвердить наличие паразитарного процесса, его локализацию, стадию развития, форму.
На фоне биохимического исследования крови обращают внимание на следующие показатели:
- Концентрация эозинофилов в биологической жидкости. Эозинофилы являются молодыми иммунными клетками. Если у человека все в порядке со здоровьем, то диагностируется не высокий уровень. Увеличенное содержание иммунных клеток косвенно свидетельствует о развитии воспалительных процессов.
- Концентрация свободного/связанного билирубина – вещество, являющееся продуктом распада гемоглобина, компонент желчи. Когда закупориваются желчные протоки гельминтами, билирубин в большом количестве поступает в биологическую жидкость.
- Активность ферментов – трансаминаз и щелочной фосфатазы. В нормальном состоянии они находятся в клетках печени. Гельминты приводят к тому, что их можно обнаружить в крови пациента.
Если говорить в целом, общий анализ крови помогает определить наличие патологического процесса в организме, а биологическое исследование материала выявляет степень поражения органов. Чтобы выявить чужеродные агенты требуется провести исследование на антитела.
ИФА и ПЦР
Иммуноферментный анализ с точностью до 70% показывает наличие заражения. Суть методики – определение уровня иммуноглобулинов класса G и M. Это антитела иммунной системы, которые продуцируются на фоне паразитарного «соседства». Иммуноферментный анализ позволяет обнаружить заболевание на самой начальной стадии развития – до того, как гельминты отложат яйца.
Если подозревается острое течение патологии, то ИФА – наиболее достоверный способ диагностики. Когда заболевание трансформировалось в хроническую форму, его используют в качестве вспомогательного варианта.
Чувствительность ИФА на паразитов в острой форме приближается к 100%, а при хроническом течении эффективность исследования не выше 70%. Однако иммуноферментный анализ в ряде клинических картин способен привести к ложноположительному либо ложноотрицательному результату.
Важно: иммуноферментный анализ может дать ложноположительный результат, если в анамнезе специфические патологии дыхательной системы, нарушение функциональности желудочно-кишечного тракта, печени, желчного пузыря и его протоков, токсоплазмоз, токсокароз. Не исключается получение ложноотрицательного результата на фоне иммунодефицита, приема некоторых лекарственных препаратов – химиопрепараты, антибактериальные таблетки.
Полимеразная цепная реакция – информативный метод, позволяющий определить генетическую составляющую гельминтов, выявить конкретную разновидность паразитов. В качестве биологического материала могут использовать урину, кровь, слюну, каловые массы.
Отличие ПЦР от других методов исследования заключается в том, что полимеразная цепная реакция не только выявляет заражение, но и показывает количество гельминтов в организме человека. После забора крови результат готов в течение 24 часов. Противопоказания у процедуры отсутствуют.
Другие анализы на описторхоз
Помимо ПЦР и ИФА медицинский специалист может рекомендовать другие методы исследования на наличие паразитов в организме. К ним относят:
- Анализ фекалий на наличие/отсутствие яиц кошачьей двуустки;
- Анализ мочи;
- Ультразвуковое исследование брюшной полости;
- Дуоденальное зондирование.
Посредством исследования кала в лабораторных условиях можно найти яйца гельминтов. Для точной диагностики фекалии берутся несколько раз, поскольку яйца выделяются нерегулярно. Этот же метод применяется после медикаментозного лечения, чтобы убедиться в эффективности терапевтического курса.
Стоит знать: ультразвуковое исследование внутрибрюшной полости позволяет визуализировать уплотнение стенок желчного пузыря, протоков, расслоение слизистых стенок печени, в которых находятся паразиты.
Дуоденальное зондирование – метод диагностики, в ходе которого в двенадцатиперстную кишку вводится раздражитель, чтобы активизировать сокращение желчного пузыря. Это приводит к тому, что желчь вытекает в 12-перстную кишку, откуда она берется для дальнейшего изучения.
Подготовка к исследованию
Чтобы результаты анализа крови на описторхоз показали верный результат перед исследованием необходимо осуществить подготовительные мероприятия. Медицинские специалисты рекомендуют пациентам придерживаться следующих правил перед сдачей крови:
- Забор биологической жидкости осуществляется только на голодный желудок. Период голодания не менее восьми часов;
- За 48 часов до исследования требуется отказаться от употребления спиртных напитков;
- За 10-12 часов исключают физические нагрузки;
- За одну неделю до забора крови отказаться от применения медикаментозных препаратов; если это сделать невозможно, информировать врача с перечнем принимаемых лекарственных средств.
Диагностика другими методами – сдача кала, урины и пр., также требует определенной подготовки для исключения ложных результатов. Перед забором урины проводится тщательный туалет половых органов. Женщинам рекомендуется ввести гигиенический тампон во влагалище.
Забор каловых масс нельзя осуществлять после клизменных процедур, применения слабительных препаратов и пр. Их собирают при последнем акте опорожнения кишечника, соблюдая все правила хранения, доставляют в лабораторию.
За два-три дня до исследования рекомендуется отказаться от продуктов питания, которые провоцируют повышенное газообразование и вздутие живота. К ним относят бобы, фасоль, газированные напитки, свекла, капуста и пр.
По статистике ложные результаты обнаруживаются у 2% пациентов, которые ранее не более описторхозом.
Расшифровка анализов
Расшифровка анализа крови на описторхоз имеет определенные сложности. Например, если иммуноферментный анализ показывает положительный результат, но исследование каловых масс не обнаружило яиц, то трактовать итог можно по-разному:
- Гельминты есть, но их небольшое количество;
- Паразиты присутствуют, однако не размножаются;
- Самостоятельное излечение;
- Лабораторная ошибка.
Иногда бывает наоборот, ИФА покажет, что результат отрицательный, инфицирование отсутствует, но у пациента имеются характерные признаки заражения. Тогда для уточнения обязательно проводится исследование кала.
К сведению, при наличии IgM в крови говорят об остром течении описторхоза; при обнаружении IgG о хроническом процессе.
Диагноз ставится по результатам нескольких методов. При заражении концентрация эозинофилов свыше 90%, лейкоциты > 10 x109, СОЭ выше допустимых границ, уровень гемоглобина меньше ста, лимфоциты – выше референтных значений.
При выявлении заражения назначают медикаментозное лечение. Оно включает в себя противопаразитарные лекарства, антигистаминные средства, гепатопротекторы для улучшения функциональности печени, энтеросорбенты для нормализации деятельности ЖКТ. При своевременной и адекватной терапии описторхоз успешно лечится, не приводит к развитию осложнений.
Источник: https://parazitron.ru/analizy/sposoby-analiza-krovi-na-opistorhoz-i-rasshifrovka-rezultatov.html





