Мутация Лейдена: что это такое и насколько опасна? Мутация Лейдена и беременность
В ряду гемолитических заболеваний особую группу составляют патологии, вызывающие аномальную предрасположенность крови к образованию тромбов.
Повышенная способность к коагуляции может иметь приобретенный или генетический характер.
Согласно статистике, наиболее распространенными причинами наследственной тромбофилии являются мутации в генах F2 и F5, одна из которых носит название «фактор Лейдена».
Повышенная коагулопатия врожденного характера всегда связана с нарушениями в количестве или структуре белков, участвующих в свертывании крови. В случае мутации Лейдена она обусловлена изменением аминокислотного состава протромбина, который кодируется фактором свертываемости F5.
Мутация Лейдена — что это?
В медицине некоторые заболевания называют согласно причине их возникновения.
В данном случае характер наименования патологии свидетельствует о том, что мутация Лейдена — это нарушение, связанное с аномальным изменением в определенной части человеческого генотипа.
Фенотипически оно проявляется в синтезе аномальной формы одного из коагуляционных факторов, что приводит к смещению гомеостаза в сторону повышения свертываемости крови.
Таким образом, мутация Лейдена — это наследственное заболевание, выражающееся в предрасположенности к образованию аномальных сгустков, закупоривающих сосуды, и обусловленное изменением в гене, кодирующем фактор FV. Симптоматическое проявление этого дефекта характерно лишь для небольшого числа носителей патологии, но риск тромбообразования повышен у всех.
Частота встречаемости мутации гена F5 (Лейдена) одинакова и для мужчин, и женщин. Этот наследственный дефект является причиной развития тромбозов в 20-60 % случаев. Среди всего европейского населения обладателями лейденской мутации являются 5 % людей.
Общая характеристика мутации
Мутация Лейдена проявляется в полиморфизме F5-гена, что выражается в замене одного из нуклеотидов на другой. В данном случае происходит замещение аденина гуанином в позиции G1691A матричной последовательности.
В результате по окончании транскрипции и трансляции синтезируется белок, первичная структура которого отличается от исходного (правильного) варианта одной аминокислотой (аргинин заменяется на глутамин).
Казалось бы, незначительная разница, но именно она становится причиной нарушения регуляции свертывания крови.
Для понимания связи между аминокислотной конверсией в белке F5 и гиперкоагуляцией необходимо разобраться в том, как образуется тромб. Ключевым моментом этого процесса является превращение фибриногена в фибрин, которому предшествует целая цепочка реакций.
Как образуется тромб?
В основе образования тромба лежит полимеризация фибриногена, приводящая к образованию разветвленной трехмерной сети белковых нитей, в которой застревают клетки крови. В результате формируется сгусток, закупоривающий сосуд.
Однако молекулы фибриногена начинают соединяться друг с другом только после протеолитической активации, которую осуществляет белок тромбин. Именно этот протеин выполняет роль поворотного рычага в схеме свертывания крови.
Однако в норме тромбин присутствует в крови в виде своего предшественника — протромбина, для активации которого требуется целая цепочка последовательных реакций.
Белки, которые задействованы в этом каскаде, получили названия факторов свертываемости. Они имеют римские обозначения согласно порядку своего обнаружения. Большинство факторов являются белками. Активаторами для каждого следующего звена цепочки реакций служит предыдущее.
Запуск коагуляционного каскада начинается с попадания в сосуд тканевого фактора. Затем по цепочке активируются различные белки, что в конечном итоге приводит к преобразованию протромбина в тромбин. Каждый этап каскада может быть приостановлен в результате действия соответствующего ингибитора.
Фактор V
Фактор V — образующийся в печени глобулярный белок плазмы крови, участвующий в процессе коагуляции. Этот протеин иначе называется проакцелерином.
До активации тромбином белок FV имеет одноцепочечную структуру. После протеолитического расщепления с удалением D-домена молекула приобретает конформацию двух субъединиц, соединенных слабыми нековалентными связями. Такая форма проакцелерина обозначается как FVa.
Активированный белок FV выполняет функцию коэнзима для фактора свертывания крови Xa, который превращает протромбин в тромбин. Проакцелерин служит катализатором этой реакции, ускоряя ее в 350 тысяч раз. Таким образом, без фактора V завершающая стадия коагуляционного каскада длилась бы очень долго.
Механизм патологического действия мутации
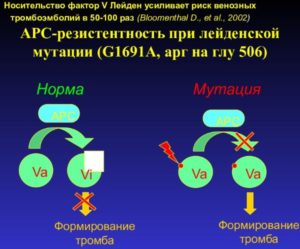
Нормальный белок FV инактивируется протеином С, который вступает в действие, когда необходимо прекратить коагуляцию. Фактор С связывается с определенным сайтом FVa и переводит его в форму FV, прекращая катализ образования тромбина.
При наличии мутации Лейдена синтезируется белок, который не восприимчив к действию протеина С (АРС), поскольку аминокислотная замена происходит именно на участке взаимодействия с ингибитором.
Как следствие, фактор Va не может быть дезактивирован, что значительно снижает эффективность отрицательной регуляции, необходимой для остановки формирования кровяного сгустка и последующего его разжижения.
Таким образом, можно сделать вывод о том, что мутация Лейдена — это патология, проявляющаяся через сопротивление антикоагулянтной активности и таким образом повышающая риск развития тромбоза. Данное явление получило название протеин-С-резистентности.
Свойства мутантного белка
Кроме резистентности к протеину С полиморфизм гена F5 придает синтезируемому на его основе белку еще два свойства:
- способность усиливать активацию протромбина;
- увеличение кофакторной активности в отношении инактивации FVIIIa-белка, который задействован в торможении коагуляции.
Таким образом, мутантный фактор V одновременно работает в двух направлениях. С одной стороны, он запускает процесс свертывания крови, а с другой — мешает регуляторным белкам его остановить. А ведь именно механизмы супрессии (подавления) предохраняют организм от патологических проявлений многих физиологических реакций (например, воспалительных).
Таким образом, можно сказать, что мутация Лейдена — это наследственное явление, которое нарушает отрицательную регуляцию свертывания крови, повышая риск образования аномальных тромбов, вредных для нормального функционирования организма. При такой патологии один из коагуляционных факторов всегда активен.
Тем не менее ежесекундного и повсеместного образования тромбов у таких людей все же не происходит, поскольку в свертывании крови участвует множество белков, взаимосвязанных друг с другом и с системами регуляции. Поэтому нарушение работы одного фактора не приводит к радикальному сбою всего механизма ингибирования коагуляции. Во всяком случае, фактор V не является ключевым рычагом управления системой свертывания.
Как следствие, утверждать, что мутация Лейдена — это генетическое нарушение, непременно приводящее к тромбофилии, неправильно, поскольку белок действует не напрямую, а опосредованно, через нарушение механизма отрицательного контроля. Кроме выключения фактора V в организме присутствуют и другие пути остановки процесса коагуляции. Поэтому мутация Лейдена лишь ухудшает дезактивацию системы свертывания, а не полностью уничтожает ее.
Кроме того, патология проявляется лишь в случае, когда образование тромба уже инициировано какими-либо причинами. До запуска коагуляционного каскада присутствие мутантного белка не вызывает в организме никаких изменений.
Патогенез и симптомы
В большинстве случаев мутация Лейдена не имеет никаких симптоматических проявлений. Носитель может спокойно жить, даже не подозревая о ее существовании. Но иногда наличие мутации приводит к периодическому образованию тромбов. В таком случае симптоматика будет зависеть от места локализации кровяных сгустков.
Риск развития тромбоза зависит от количества мутировавших генов F5. Наличие одной копии повышает вероятность образования аномальных сгустков в 8 раз по сравнению с обладателем нормального генотипа в данном локусе. В таком случае мутация Лейдена считается гетерозиготной. При наличии в генотипе гомозиготы (двух копий мутировавшего гена) риск тромбофилии увеличивается до 80 раз.
Чаще всего симптоматическое проявление мутации Лейдена провоцируют другие факторы тромбоза, включая:
- уменьшение циркуляции кровотока;
- серьезные патологии сердечно-сосудистой системы;
- малоподвижный образ жизни;
- прием заместителей гормональной терапии (ЗГТ);
- операции;
- беременность.
Образование аномальных сгустков встречается у 10 % носителей мутации. Наиболее часто патология проявляется в ТГВ (тромбозе глубоких вен).
Тромбоз глубоких вен
Чаще всего тромбоз глубоких вен локализуется в нижних конечностях, но может развиваться также в мозге, глазах, почках и печени. Возникновение кровяных сгустков в ногах может сопровождаться:
- припухлостью;
- болью;
- повышением температуры;
- покраснением.
Иногда ТГВ не имеет симптоматических проявлений.
Тромбоз поверхностных вен
Тромбоз поверхностных вен при мутации Лейдена встречается гораздо реже, чем глубоких. Обычно он сопровождается покраснением, повышением температуры и болезненностью в области образования сгустка.
Образование сгустков в легких
Образование тромба в легких (иначе легочная эмболия) — одно из опасных проявлений мутации Лейдена, сопровождающееся такими симптомами, как:
- внезапная одышка;
- боль в грудной клетке при вдохе;
- выделение кровяной мокроты при кашле;
- тахикардия.
Данная патология является осложнением ТГВ и возникает, когда тромб отрывается от венозной стенки и через правый отдел сердца попадает в легкие, блокируя кровоток.
Опасность мутации при беременности
При беременности мутация Лейдена сопровождается небольшим риском появления выкидыша или преждевременных родов. Частота таких явлений у женщин с полиморфизмом гена F5 в 2-3 раза выше. Беременность также повышает риск развития тромбоза у носителей мутации.
Некоторые исследования показывают, что наличие фактора Лейдена увеличивает вероятность развития следующего ряда осложнений:
- преэклампсия (высокое кровяное давление);
- замедленный рост плода;
- преждевременное отделение плаценты от стенки матки.
Несмотря на эти риски, у большинства имеющих данную мутацию женщин беременность протекает нормально. Фактор Лейдена даже дает определенное преимущество, уменьшая вероятность развития обширного послеродового кровотечения. Тем не менее всем женщинам с мутацией Лейдена в период беременности рекомендован строгий медицинский контроль.
Лечение заболевания
Лечение мутации Лейдена осуществляется только при наличии тромбофилии и носит симптоматический характер. Исключить причину заболевания невозможно, поскольку медицина не обладает методами, позволяющими изменять геном.
Патологические проявления мутации Лейдена устраняются путем приема антикоагулянтов. В случае периодически повторяющегося тромбоза эти препараты назначаются на регулярной основе.
Источник: https://FB.ru/article/435057/mutatsiya-leydena-chto-eto-takoe-i-naskolko-opasna-mutatsiya-leydena-i-beremennost
Мутации генов гемостаза MTHFR – что это значит и что с этим делать

Мутация гена MTHFR является проблемой, связанной с плохим метилированием и продукцией ферментов. Мутации генов гемостаза MTHFR влияют на каждого человека по-разному. Иногда они приводят к едва заметным симптомам, а иногда приводят к серьезным, долговременным проблемам со здоровьем.
Хотя точный показатель распространенности все еще остается предметом дискуссий, считается, что 30%-50% всех людей могут иметь мутацию в гене MTHFR, который наследуется и передается от родителя к ребенку.
Как правило, это гетерозиготная мутация. Приблизительно от 14% до 20% процентов населения могут иметь более тяжелую мутацию MTHFR, которая более резко влияет на общее состояние здоровья.
Она называется гомозиготной мутацией.
Разница состоит в том, что гетерозигота – это мутация в одной аллели пары генов. То есть шанс ее проявления составляет 50%. А гомозигота – мутация в обеих аллелях пары генов, проявление в 100% случаев.
Мутация гена MTHFR была обнаружена во время завершения проекта генома человека. Исследователи поняли, что люди с этим типом наследственной мутации имели большую вероятность развития определенных заболеваний. К ним относятся: СДВГ, болезнь Альцгеймера, атеросклероз, аутоиммунные расстройства и аутизм.
Еще многое предстоит узнать о том, что означает этот тип мутации для людей, которые несут ее и продолжают передавать своим детям.
На сегодняшний день существуют десятки различных состояний здоровья, связанных с мутациями MTHFR. Но еще раз подчеркнем, что даже если вы являетесь носителем мутации – не факт, что у вас будут ее проявления. Мутация означает лишь повышение рисков.
Что такое мутация генов MTHFR
MTHFR — это ген, который обеспечивает организм инструкциями по производству определенного фермента, называемого метилентетрагидрофолатредуктаза . То есть MTHFR — сокращенное название этого фермента.
Есть две основные мутации MTHFR, на которых исследователи фокусируются чаще всего. Эти мутации часто называют «полиморфизмами» и влияют на гены, называемые MTHFR C677T и MTHFR A1298C.
Также эти мутации называют – мутациями фолатного цикла, потому что они показывают, как организм преобразует фолиевую кислоту в активную форму для наилучшего усвоения.
Соответственно, если у вас есть мутации генов гемостаза MTHFR, то ваш организм плохо усваивает фолиевую кислоту и другие витамины группы B, особенно В12. Что делать в этом случае – читайте далее.
Мутации могут происходить в разных местах этих генов и наследоваться только от одного или обоих родителей. Наличие одного мутантного аллеля связано с повышенным риском определенных проблем со здоровьем, но наличие двух увеличивает риск намного больше.
Мутация гена MTHFR может изменить способ, которым некоторые люди метаболизируют и преобразовывают важные питательные вещества из своего рациона в активные витамины, минералы и белки.
Генетические мутации также могут изменять уровни нейротрансмиттеров и гормонов.
В некоторых случаях, хотя и не во всех, изменения в работе этого фермента могут влиять на параметры здоровья, включая уровень холестерина, функцию мозга, пищеварение, эндокринные функции и многое другое.
Часть о мутациях генов гемостаза MTHFR впервые узнают после анализа причин замершей беременности
1. Потребляйте больше натурального фолата, витамина В6 и витамина В12
В случае с мутациями генов фолатного цикла важно употреблять много продуктов, богатых витаминами B6, B9 и B12.
Вы также можете принимать их в виде добавки. Однако, помните, что людям с мутациями MTHFR труднее переводить синтетическую форму фолиевой кислоты в биодоступную. Более того, прием обычной фолиевой кислоты может вызвать ухудшение симптомов.
Получение достаточного количества фолиевой кислоты особенно важно до и во время беременности. За три месяца до зачатия и в течение первого триместра беременности матери, которые получают достаточно фолиевой кислоты, снижают риск развития у детей различных проблем со здоровьем.
Людям с мутациями MTHFR критически важно получать биодоступные формы фолата в добавках, называемых L-метилфолатом или метильной формой витамина В9.
L-метилфолат сложнее упаковывать в форме капсул, поэтому вы, возможно, не сможете получать очень высокие дозы в типичных поливитаминах или добавках. Поэтому рекомендуется принимать моно-добавки под называнием 5-MTHF.
Now Foods, Метилфолат, 5000 мкг, 50 вегетарианских капсул
Thorne Research, 5-МТГФ, 5 мг, 60 капсул
Если у вас обнаружена мутация MTHFR в форме гомозиготы, то метильные комплексы фолиевой кислоты вам необходимо пропивать постоянно курсами — минимум 3 раза в год.
Наличие большего количества фолиевой кислоты в вашем рационе означает, что вы лучше способны создавать активную форму 5-MTHF. Некоторые из лучших продуктов с высоким содержанием фолиевой кислоты включают в себя:
- Фасоль и чечевица
- Листовые зеленые овощи, такие как сырой шпинат
- Спаржа
- Ромэн
- Брокколи
- Авокадо
- Яркие фрукты, такие как апельсины и манго
Источник: https://blisswoman.ru/shemy/mutatsii-genov-gemostaza-mthfr-chto-eto-znachit-i-chto-delat/
Гетерозиготная мутация что это значит при беременности
› Вопросы
05.12.2019
Лейденовская мутация – это изменение одного или двух (гетеро-, гомозигота) участков в гене, кодирующем активность V фактора свертывания крови, проакцелерина. В результате F5 становится устойчивым к воздействию протеина С – естественного антикоагулянта, нарушаются противотромботические механизмы крови и организм находится в постоянной тромботической готовности.
Мутация Лейдена – самая распространенная причина наследственной склонности к тромбозам, инфарктам, инсультам и акушерским осложнениям у людей европеоидной расы. Патология названа в честь города Лейден (Голландия), где впервые был описан механизм ее возникновения.
Почему вы узнали о мутации Leiden только сейчас
Нечувствительность к протеину С сразу у нескольких членов одной семьи впервые выявлена шведским ученым Б. Дальбеком в 1993, а детально описана голландским профессором Р. Бертиной в 1994 году.
Открытие внесло коррективы в диагностику нарушений гемостаза и акушерских осложнений – теперь любой случай тромбоза или патологии беременности в анамнезе врачи связывают с возможной тромбофилией. Согласно данным последних исследований, полиморфизм гена F5 – главная причина генетической тромбофилии у 5-8% населения Земли.
Его распространенность варьируется в зависимости от региона: достигает 15% у жителей Греции, Швеции, Ливана и практически не встречается в Африке, Азии, Гренландии и отдельных районах Северной Америки.
Что такое фактор V
F5, проакцелерин, фактор Лейдена – это молекула белка, В-глобулин, которая образуется в печени человека, циркулирует в крови и участвует в каскаде свертывания.
Благодаря F5 фактор 10 прикрепляется к тромбоциту и активирует протромбин. Также проакцелерин играет важную роль в инактивации комплекса протромбиназы: в норме молекула фактора V разрушается протеином С, после чего протромбиназный комплекс распадается.
Как мутация Лейдена влияет на тромбообразование
При Leiden-мутации в клетке ДНК, кодирующей фактор 5, происходит замена белка-нуклеотида гуанина на аденин в позиции 1691 (G1691A). Изменяется порядок аминокислот в составе «готового» F5 – в 506 положении глутамин сменяет аргинин.
В результате повреждается одно из 3 мест расщепления фактора V, и он теряет чувствительность к воздействию естественного антикоагулянта, протеина С. Действие F5 длится дольше обычного, из-за чего кровь становится излишне вязкой. Нарушается система комплекса протромбиназы, высвобождается больше тромбина и возрастает риск тромбоза.
Вероятность тромбоэмболического события увеличивается с возрастом и при сочетании Лейденовской с мутациями других генов гемостаза – протромбина, протеинов С и S. В развитии тромбозов у носителей полиморфизма фактора V играет роль и ряд других факторов: беременность, прием гормонов, климактерический период, травмы, инфекционные болезни, хирургические операции.
Признаки и симптомы
Полиморфизм фактора 5 Leiden – генетически детерминированное заболевание.
Патология присутствует у человека с рождения, но дает о себе знать только в зрелом возрасте или под воздействием «провоцирующих» факторов – травмы, длительной иммобилизации во время болезни или после операции, при наступлении беременности. До этого момента клинические проявления носительства мутации обычно отсутствуют.
Лейденская мутация – самое значимое нарушение гемостаза, приводящее организм в предтромботическое состояние. При подозрении на тромбофилию анализ на фактор V является приоритетным. В зоне особого риска находятся пациентки с рецидивирующими тромбозами и невынашиванием беременности.
Почему мутация Лейдена опасна для беременных женщин
Во время беременности в организме включается адаптивный механизм: физиологическая гиперкоагуляция, которая нарастает с каждым триместром и достигает максимума в момент родов. Так срабатывает «программа защиты» от массивной кровопотери после родоразрешения.
Но для носительницы полиморфизма гена F5 этот процесс становится патологическим и может привести к тяжелым осложнениям. Уже доказано, что мутация Лейдена – главная причина:
75% случаев невынашивания беременности, синдромов потери плода; 90% случаев ПОНРП, преждевременной отслойки плаценты; 75% случаев резкого подъема уровня артериального давления и поздних токсикозов, а также внутриутробной задержки роста плода, самопроизвольного аборта на сроках как до 12, так и до 20 недель беременности, неудач ЭКО, преждевременных родов, синдрома системного воспалительного ответа. Акушерские осложнения можно предупредить, если на этапе планирования, и даже во время беременности обратиться к квалифицированному врачу гемостазиологу, который назначит поддерживающую антикоагулянтную терапию.
Полиморфизм гена фактора V: лечится или нет
«Поправить» дефектный ген в молекуле ДНК невозможно, но гемостазиологи предлагают, как вариант, предупредить осложнения тромбофилии профилактическими мерами. Медикаментозная терапия при мутации Лейдена назначается, исходя из прогнозируемого по результатам анализа риска тромбозов:
- Гетерозиготная мутация (дефектный 1 из двух аллелей гена проакцелерина) имеет более благоприятный прогноз. В этом случае антикоагулянты назначаются только при беременности, перед планируемой операцией, при серьезных травмах и приеме ЗГТ. Риск тромбоза при гетерозиготной форме МLeiden повышен в 7 раз, при беременности – в 15 раз.
- Гомозиготная форма (повреждены оба аллеля) или комбинация Лейденской с мутацией гена F2, протеинов-антикоагулянтов С и S является показанием для перманентной, постоянной противотромботической терапии. У носителей гомозиготного полиморфизма F5 или мультигенной тромбофилии вероятность тромбоза в 20, 80, 100 раз выше (в зависимости от количества дефектных генов) по сравнению со здоровым человеком.
Обследование и сопровождение пациентов с мутацией Лейдена проводят в МЖЦ на Таганской – профильной клинике под руководством Татьяны Владимировны Кузнецовой, профессоров Александра Давидовича Макацария и Виктории Омаровны Бицадзе. На базе нашей Научной лаборатории патологии гемостаза вы сможете сдать анализ на мутацию в гене FV Leiden, который позволит определить риск тромбофилии и подобрать оптимальную противотромботическую терапию.
Читать еще: Применение валокордина при низком давлении
акушер-гинеколог, гемостазиолог, профессор, доктор медицинских наук, эксперт международного уровня по проблемам тромбозов и нарушений свертывания крови
Мутации гемостаза при беременности
Здравствуйте, нахожусь на 5,5 неделе беременности после ЭКО, сдала анализ на мутации гемостаза и вот какие результаты: PAI-1(-675 5g/4g) в гетерозиготной форме, ITGA2 (807 С больше T) в гетерозиготной форме, F13A1(103 G больше T) в гетерозиготной форме, MTHFR (1298 A больше C) в гомозиготной форме, MTRR (66 A больше G) в гомозиготной форме.
АФС нет, коагулограмма на данный момент была в норме. Гомоцистеин 7,но продолжаю снижать фолатами.Была уже одна замершая беременность на 8 неделе.
Подскажите пожалуйста как быть дальше? Нужно ли колоть низкомоллекулярные гепарины и в какой дозе? В нашем городе нет гематолога, обратиться с этим вопросом не к кому (спасибо вам большое за ваш труд!
На сервисе СпросиВрача Вы можете задать вопрос гематологу по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно. Задайте свой вопрос и получите ответ сразу же!
Здравствуйте!Согласно данным вам необходимо регулировать фолатный цикл приёмом Фолиевой кислоты. Коагулограмму сдавали на фоне беременности?
Если да, то на данный момент нет оснований для назначения гепаринов.
Выявленные тромбофилии требуют лечения при определённых показаниях, которых у вас нет (коагулограмма в норме, тромбозов ни у кого не было).
Мутация Лейдена (гетерозиготный тип)
Девочки, кто выносил и родил или сейчас носит беременность с этой мутацией, вопрос к вам: какие препараты и в какой дозе вам назначали для профилактики тромбофилии во время беременности? Буквально 2 дня назад узнала, что у меня эта мутация, была у двух врачей, мнения разделились, пытаюсь понять, кто из врачей ближе к истине.
У меня такая мутация + гетерозиготные мутации фолатного цикла, но я об этом не знала и выносила без лечения, правда в 25 лет — у молодых часто всё прокатывает)
Татьяна, спасибо) Посту 2 года. Ту беременность доносила и родила без препаратов. Эта уже вторая))
Источник: https://pro-serdze.ru/voprosy/geterozigotnaya-mutatsiya-chto-eto-znachit-pri-beremennosti.html
Мутация Лейдена — причины, симптомы, кто подвержен
Мутация Лейдена является одной из основных причин тромбофилии. Патология является генетическим нарушением свертываемости крови. Более подробно о ее причинах и опасностях рассказывается в тексте.
Что это такое
Патологию иногда называют хронической тромбофилией. Мутация Лейдена впервые была выявлена в голландском городе Лейден в 1993 году, откуда и взяла свое название. По факту это мутация гена протромбина, при котором кодируется белок в крови и нарушается ее свертываемость.
У всех людей с фактором Лейдена развивается тромбофилия и появляются сгустки в сосудах.
У большинства пациентов болезнь проходит бессимптомно и зачастую не несет никакого вреда. Без специальной диагностики определить нарушение очень сложно.
Симптоматика зависит напрямую от места возникновения тромба. Это связано с тем, что сгустки могут появляться во всех типах кровеносных сосудов и локализовываться в любой точке организма.
Нередко тромбы вызывают повышение температуры тела из-за недостатка кислорода и возникновения воспалительного процесса в мягких тканях.
Причины
Нарушение имеет генетический характер и передается по наследству. Основная его причина – наличие сбоя в участке генной цепи, отвечающим за определенный фактор свертывания крови. Он называется F5 или проакцелерин.
Данная молекула белка вырабатывается печенью человека. Циркулируя в кровяной жидкости, он прикрепляется к тромбоциту и способствует увеличению уровня протромбина.
Предрасполагающими факторами к развитию патологии является наличие данной болезни у одного или обоих родителей. Также на образование нарушения влияет гормональная терапия, период климакса, инфекционные патологии, оперативные вмешательства.
Чем опасна
Фактор Лейдена нарушает свертываемость крови, из-за чего могут возникнуть сопутствующие заболевания. Это предрасположенность к формированию тромбов, которые образуются в сосудах и закупоривают их. В результате чего и возникают проблемы.
- Варикозное расширение вен – патология, возникающая из-за закупорки сосудов, нарушения работы клапанов и эластичности стенок вен и артерий.
- Атеросклероз – это заболевание сердечно-сосудистой системы, которое возникает в большей части из-за повышенного холестерина в крови. Если в этот момент есть нарушение свертываемости, бляшки образуются не только из жира, но их частиц загустевшей крови.
Мутация Лейдена и беременность плотно связаны между собой, потому что патология влечет осложнения для плода и будущей мамы.
Заболеванию могут подвергаться представители обоих полов, но риск возникновения болезни выше у женщин во время вынашивания ребенка.
Нужна ли диагностика
Диагностика необходима, потому что она позволит определить и контролировать активность патологии. Чем раньше мутация Лейдена выявлена, тем проще ее корректировать и проводить профилактику против множества заболеваний сердечно-сосудистой системы.
Чтобы подтвердить или опровергнуть наличие мутации свертываемости крови, специалисты проводят следующие методы диагностики:
- изучение анамнеза, хронический и врожденных патологий;
- развернутая коагулограмма – тесты для диагностики системы гемостаза, позволяющие определить интенсивность тромбообразования.
Если определяется наличие мутации и ее осложнения, тогда рекомендуется проводить УЗИ и МРТ, чтобы определить количество тромбов, их локации и размеры.
В отдельных случаях назначается хирургическое вмешательство, потому что оторвавшийся тромб – это осложнение и возможный летальный исход.
Риски
В первую очередь в группе риска находятся беременные женщины. Данная проблема часто связана с рисками выкидыша или замирания плода. Также у беременных женщин из-за мутации Лейдена возникает кислородное голодание, приводящее к неправильному развитию ребенка.
Изменение гормонального фона при климактическом периоде, прием контрацептивов, склонность к рецидивирующему тромбозу также являются факторами риска. Чтобы этого избежать и минимизировать негативные последствия, рекомендуется принимать все препараты, прописанные врачом.
Профилактические меры
При лейденовской мутации нужно проводить определенные профилактические меры, чтобы уберечься от образования тромбов и снизить количество уже имеющихся. Нужно придерживаться следующих правил:
- регулярный прием рекомендованных лечащим врачом препаратов для разжижения крови;
- отказ от вредных привычек – прием алкоголя, курения, наркотических веществ;
- правильное питание, отказ от жирной, острой и соленой пищи.
Кроме этого на кровеносную систему благоприятно влияет свежий воздух. Для достаточного количества кислорода нужно ежедневно проветривать помещение, каждый день выходить на улицу на прогулки.
Совет: людям с болезнью Лейдена рекомендуется 1-2 раза в год проходить обследования у флеболога и кардиолога.
Лейденовский фактор – это не приговор. Большинство людей живут всю жизнь и не подозревают, что у них есть такое отклонение. Если же появляются симптомы в виде отечностей, болей, нарушения частоты сердечных сокращений – нужно пройти обследование у врачей.
Материал подготовлен
специально для сайта venaprof.ru
под редакцией врача Глушаковой Н.А.
Специальность: терапия, кардиология, семейная медицина.
Источник: https://venaprof.ru/mutatsiya-leydena/
Мутация Лейдена: что это такое, причины – Как лейденовская мутация влияет на беременность — Медицинский женский центр в Москве

Нечувствительность к протеину С сразу у нескольких членов одной семьи впервые выявлена шведским ученым Б. Дальбеком в 1993, а детально описана голландским профессором Р. Бертиной в 1994 году. Открытие внесло коррективы в диагностику нарушений гемостаза и акушерских осложнений – теперь любой случай тромбоза или патологии беременности в анамнезе врачи связывают с возможной тромбофилией.
Согласно данным последних исследований, полиморфизм гена F5 – главная причина генетической тромбофилии у 5-8% населения Земли. Его распространенность варьируется в зависимости от региона: достигает 15% у жителей Греции, Швеции, Ливана и практически не встречается в Африке, Азии, Гренландии и отдельных районах Северной Америки.





